
Processo de Combustão
A combustão do carbono com o oxigênio é representada pela seguinte reação química:
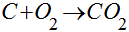
Ela indica que um mol de carbono reage com um mol de oxigênio para formar um mol de dióxido de carbono ou que 12 g de carbono reagem com 32 g de oxigênio para formar 44 g de dióxido de carbono.
Quando o combustível é um hidrocarboneto, o hidrogênio e o carbono são oxidados.
Considerando o metano - CH4 - como combustível, a combustão é dada pela seguinte reação química:
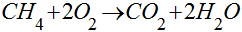
Neste caso, a combustão gera dióxido de carbono e água. A água gerada pode estar no estado sólido, líquido ou gasoso, dependendo da temperatura e pressão dos produtos da combustão.
Nos processos de combustão utilizados para geração de energia elétrica, utiliza-se o oxigênio existente no ar e não o oxigênio puro. A composição do ar, em base molar, é aproximadamente 21% de oxigênio, 78% de nitrogênio e 1% de argônio.
O Argônio é normalmente desprezado nos problemas de combustão que envolvem o ar.
Desta maneira, a composição do ar é aproximada como sendo 21% de oxigênio e 79% de nitrogênio. No entanto, quando isto é feito, é necessário ajustar o peso molecular do nitrogênio para levar em consideração o argônio. Este nitrogênio é chamado de “nitrogênio atmosférico” e possui um peso molecular de 28,013.
Supondo o ar composto apenas por nitrogênio e oxigênio, a combustão do metano com ar seguiria a seguinte reação química:
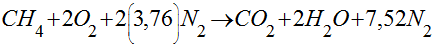
A quantidade mínima de ar que fornece oxigênio suficiente para a combustão completa de um combustível é denominada de ar teórico. Isto significa que os produtos da reação química não contém oxigênio.
Generalizando a equação anterior para qualquer hidrocarboneto, teremos que:
![]()
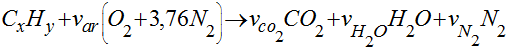
Onde os coeficientes das espécies químicas são chamados de coeficientes estequiométricos e são determinados, considerando a conservação das espécies químicas, por:
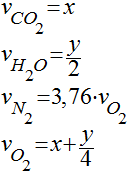
Portanto, a queima completa de um hidrocarboneto puro pode ser escrita da seguinte maneira:
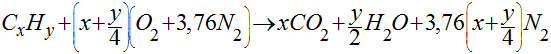
O número total de moles de ar por moles de combustível é dado por:
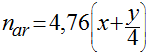
Esta quantidade é igual a 100% do ar teórico, porém a combustão completa só é obtida na prática quando a quantidade de ar fornecida é maior do que a quantidade teórica. Em função disso, três parâmetros são definidos para representar a real quantidade de ar utilizada na combustão; a relação ar-combustível (AC), seu recíproco, a relação combustível-ar (CA) e a percentagem do ar teórico - Φ. Eles são definidos em base de massa ou em base molar da seguinte maneira:
Onde:
Onde o índice e representa a relação estequiométrica. É importante ressaltar que a percentagem de ar teórico - Φ - independe da base utilizada. O percentual de ar teórico é utilizado para indicar se a mistura ar-combustível é rica ( Φ>1), pobre ( Φ<1) ou estequiométrica ( Φ=1).
Exemplo 1: Combustão completa do Metano
Exemplo 2: Combustão do Octano
Quando a quantidade de ar é inferior ao ar teórico, a combustão é chamada de incompleta. Neste caso, existe também a formação de monóxido de carbono e hidrocarbonetos. Na prática, como a mistura ar combustível nem sempre é homogênea, existe sempre uma queima incompleta mesmo com excesso de ar.
Quando a queima é incompleta a combustão passa a seguir a seguinte reação:

Esta relação além de gerar o venenoso monóxido de carbono ela não utiliza toda a energia química disponível no combustível. Portanto, a combustão incompleta é indesejável tanto do ponto de vista ambiental como do ponto de vista energético.
Exemplo 3: Combustão incompleta do Metano